SHIGELLA
Ekim 19, 2018
Shigella spp. (TÜRKÇE)
SHIGELLA SPP.
Morfolojisi
Shigella hareketsiz, sporsuz, kapsülsüz, gram negatif (-) basildir. Hareketsiz olmaları ile Salmonellalardan ayrılır; bakteriyolojik boyalarla kolay boyanır, Shigella flexneri'nin bazı tipleri dışında, Shigella basillerinde fimbria yoktur.
Üreme Özellikleri
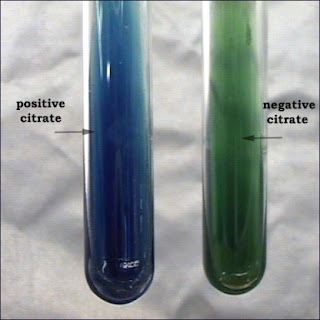
Shigella, aerob veya fakültatif anaerob bakteridir. Optimal üreme ısısı 37oC‟dir; ancak 8-40 oC‟de de üreyebilir. Optimal pH‟sı 7.2-7.4‟dür. Gaita içinde bulunan koliform bakteriler tarafından hızla asitleştirildiği için birkaç saatte ölür. Dış ortam koşullarında oldukça dirençlidir. Isıya, güneş ışığına ve antiseptiklere dirençli değildir. Klorlu sularda harap olur. Adi besiyerinde kolay ürer, buyyonda homojen bulanıklık yapar. Jelozde yuvarlak, hafif kabarık, düzgün yüzeyli, saydam, E.coli kolonilerine benzer S tipi koloni oluşturur. Shigella sonnei kolonileri, diğerlerine göre daha büyüktür. Endo, EMB, MacConkey besiyerlerinde renksiz koloni oluşturur. S.sonnei hariç, laktoz negatiftir (-).TSİ besiyerinde asit yapar, gaz oluşturmaz, H2S yapmaz, üre ve sitrat negatiftir. Shigella dysenteriae hariç, diğer Shigellalar mannit (+) tir.
Antijenik Özellikleri
Shigellalarda, O antijeni vardır. Shigella dysenteriae‟nin ekzotoksin ve endotoksini vardır. Bu toksinler, nöro ve enterotoksin (sinir ve bağırsak üzerine etkili) yapısındadır.
Yaptığı Hastalıklar
Shigella dysenteriae basilli, dizanteriye neden olur.

Laboratuvar Teşhisi
➤İnceleme örnekleri: Taze gaita, rektal sürüntü.
➤Teşhis yöntemleri
➧ Mikrobiyolojik örneğin direkt mikroskobik incelemesi
Taze gaitanın kanlı ve mukuslu kısımlarından hazırlanan preparat, direkt olarak mikroskopta incelenir. Amipli dizanteriden ayırt edebilmek için özellikle Entamoeba histolitica'nın kist ve trofozoit formları ile Giardia, Trichomonas ve Balantidium coli gibi protozoalar araştırılır. Basilli dizanteride gaitada bol lökosit, eritrosit, epitel hücreleri görülür. Mukus bulanık ve kan ortasında ayrı durur. Amipli dizanteride ise az lökosit bulunduğundan mukus daha parlak ve kanla karışıktır.
Rektal sürüntü alınan eküvyonlar stuart saklam besiyerine daldırılırak laboratuvara gönderilir. Temiz bir lam üzerine mukuslu ve kanlı kısımdan örnek alınır, üzerine lamel kapatılır. Lam önce ısıtılır, sonra el değecek kadar soğutularak varsa amiplerin hareketi aktif hale getirilir, preparat mikroskopta incelenir. Entamoeba histolitica ve diğer protozoalar araştırılır.
➤Kültür; taze gaitanın kanlı ve mukuslu kısımlarından Selenit-F, ENDO, EMB, MacConkey, SS, deoksikolat sitratlı agar besiyerlerinden birine tek koloni ekimi yepılır. 24 saat sora üreyen şeffaf, renksiz, küçük koloniler Shigellalar için şüphelidir. Daha sonra bu kolonilerden saf kültür yapılır.
➤ Biyokimyasal testler; lam aglütinasyonu, TSİ, üre, sitrat, indol, mannit ve hareket testleri yapılır
INSTAGRAM
FACEBOOK
TWITTER